Nuevas investigaciones a cargo de especialistas del Consejo Nacional de Investigaciones Científicas y Técnicas (CONICET) permiten avanzar en la búsqueda de un tratamiento para “corregir” proteínas que por ser defectuosas causan la ataxia de Friedreich.
Esta es una enfermedad genética cuyo principal síntoma es la dificultad para coordinar los movimientos y afecta a niñes y adolescentes. Se caracteriza por el daño progresivo del sistema nervioso y una alteración en el corazón llamada cardiomiopatía hipertrófica, entre otros síntomas. Aunque todavía no hay cura, existen fármacos que se usan de forma paliativa.
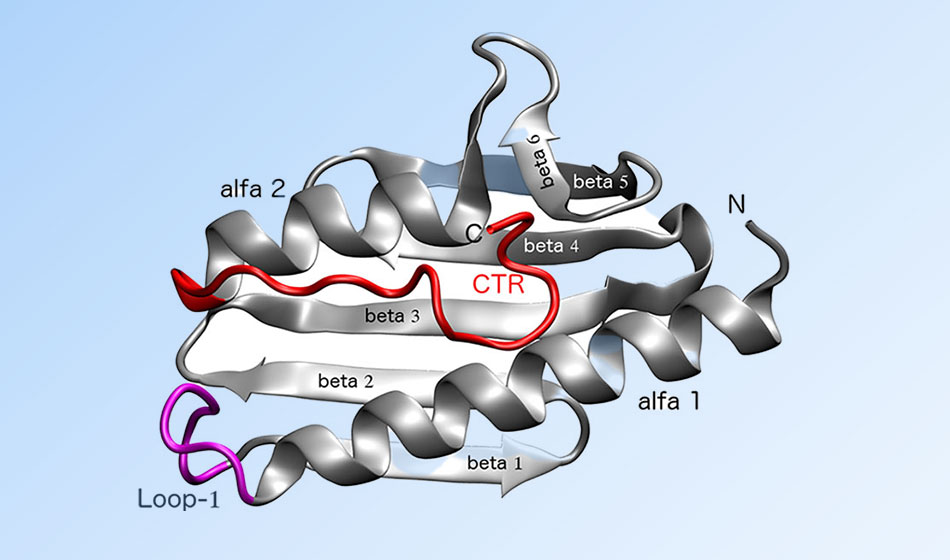
Las frataxinas son las proteínas defectuosas que causan esta ataxia. A través de estudios in vitro, les investigadores encontraron una forma de corregirlas para estabilizarlas y que así recuperen sus funciones dentro de las células. Los resultados de la investigación se publicaron en la revista internacional Biotechnology and bioengineering.
“Este trabajo fue una primera prueba de concepto con respecto a una idea que estamos manejando en el laboratorio”, explicó Javier Santos en una publicación del organismo científico. Santos es el director del estudio e investigador del CONICET en el Instituto de Biociencias, Biotecnología y Biología Traslacional (iB3), dependiente de la Facultad de Ciencias Exactas y Naturales de la UBA.
Estabilizando proteínas in vitro
Las investigaciones buscan “estabilizar proteínas defectuosas de la ataxia de Friedreich para que recuperen sus formas funcionales en el ambiente celular y en el contexto de complejos multiproteicos. Es que las proteínas no ‘viven’ solas sus vidas, sino que forman complejos entre varias”, indicó Javier Santos.
Les autores de este descubrimiento usaron un sistema llamado “Ribosome display”, que permitió seleccionar de un universo enorme de proteínas aquellas con mayor afinidad para unirse a frataxinas, que son las proteínas que causan la ataxia de Friedreich cuando son defectuosas.
Los estudios in vitro se llevaron a cabo dentro de células humanas cultivadas en el laboratorio. Permitieron comprobar que la proteína Affi_224 se podía unir a las frataxinas y modular hasta cierto punto su estabilidad, movilidad interna y su función.
“Si bien esta proteína no logró estabilizarlas como hubiéramos querido, alcanzó para comprobar la prueba de concepto. Es decir, nos indica que esta metodología podría servir para identificar moléculas terapéuticas con mayor afinidad”, agregó el científico.
“Por otra parte pudimos demostrar que Affi_224 no afecta las actividades de enzimas o proteínas que están asociadas al metabolismo mitocondrial. Esto es muy importante porque en la ataxia de Friedreich se registran alteraciones en las mitocondrias que son las fábricas de energía de las células”, indicó María Florencia Pignataro.
Pignataro es becaria postdoctoral de la Agencia Nacional de Promoción de la Investigación, el Desarrollo Tecnológico y la Innovación (Agencia I+D+i) en el grupo de Santos y primera autora del trabajo.
“La idea es identificar moléculas terapéuticas que no interfieran con ese proceso clave para la vida”, destacó.
Nuevos horizontes para más enfermedades
Los resultados de esta investigación permiten una apertura de posibilidades terapéuticas para otras enfermedades. “Nuestra idea es usar este tipo de estrategia para estabilizar variantes defectuosas, patogénicas, de proteínas que aparecen no solo en ataxia de Friedreich sino también en otras enfermedades poco frecuentes. Si bien el delivery de estas proteínas es complejo, es posible pensar en estrategias que involucren ‘variantes Troyanas’, que son proteínas con secuencias especiales que les permiten atravesar membranas celulares”, afirmó Santos.

El laboratorio que lidera también está centrado en otra prueba de concepto basada en nanoanticuerpos. “Estas moléculas son pequeñas y muy poco o nada inmunogénicas, y muy, pero muy estables. Creemos que podemos ingenierizarlas para volverlas muy afines a las frataxinas defectuosas con el propósito de corregir su función. También estamos trabajando en esta línea de investigación”, agregó.
Más de veinte nanoanticuerpos ya fueron caracterizados por equipos de Santos y de Itatí Ibañez, investigadora del CONICET en el Instituto de Química, Física de los Materiales, Medio Ambiente y Energía (INQUIMAE-UBA-CONICET).
Del trabajo también participaron María Georgina Herrera y Natalia Brenda Fernández, del CONICET y el iB3; Hernán Gustavo Gentili, del iB3; Martín Aran, del Instituto de Investigaciones Bioquímicas de Buenos Aires (IIBBA, CONICET-Fundación Instituto Leloir), y Fernando Battaglini, del INQUIMAE.

